Philippe Mauclet
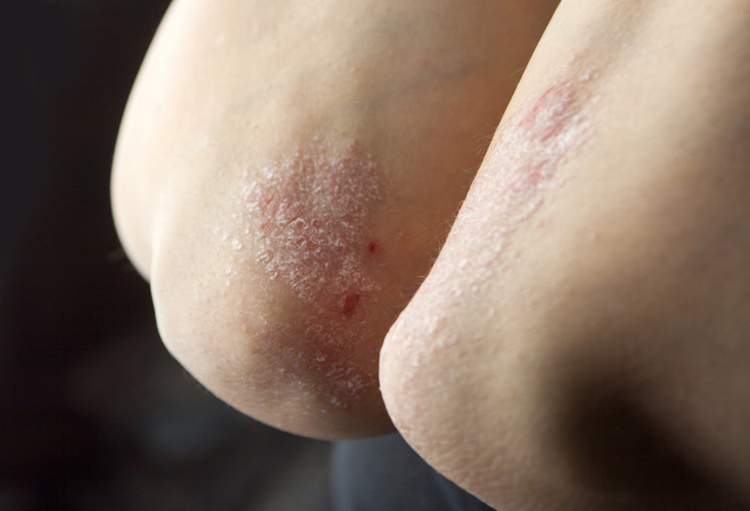
Ixekizumab, een monoklonaal antilichaam tegen IL 17A is goedgekeurd en wordt gebruikt voor de behandeling van matige tot ernstige psoriasis vulgaris bij volwassenen. Een fase III-studie heeft uitgewezen dat het bij kinderen en adolescenten het klinisch beeld en de levenskwaliteit meer verbetert dan een placebo.
Ixekizumab versus placebo… versus etanercept
Kim Papp (Toronto, Canada) legde uit dat in deze gerandomiseerde en dubbelblinde studie proefpersonen tussen 6 en 18 jaar oud werden opgenomen met een PASI (Psoriasis Area and Severity Index) ≥ 12, een sPGA (static Physician’s Global Assessment) ≥ 3 en een BSAI (Body Surface Area Involvement) ≥ 10%. De proefpersonen kwamen in aanmerking voor fototherapie of een systemische behandeling en waren onvoldoende onder controle met een topische behandeling.
Ze werden behandeld met ixekizumab om de 4 weken (n = 115) of een placebo (n = 56). De dosis van ixekizumab werd bepaald aan de hand van het lichaamsgewicht. Het primaire, samengestelde evaluatiecriterium was het percentage patiënten met een PASI 75 en een sPGA = 0,1 op week 12. Secundaire evaluatiecriteria waren het percentage patiënten met een PASI 90, PASI 100 en sPGA = 0.
In landen waar etanercept goedgekeurd is voor de behandeling van ernstige psoriasis bij kinderen, werden de patiënten volgens een 2-2-1-verhouding naar 3 groepen gerandomiseerd: ixekizumab (n = 38, dubbelblind), etanercept (n = 30, open) of een placebo (n = 19, dubbelblind). Op week 12 gingen de patiënten over naar een open fase (na een uitwasperiode voor de patiënten die etanercept kregen) en daarna naar een extensiefase. De resultaten die in Madrid gepresenteerd werden, hadden betrekking op de werkzaamheid tot week 12 en de veiligheid op langere termijn, namelijk tijdens de periode die ook de onderhouds- en de extensiefase omvatte.
Significante verbetering van PASI, sPGA, pruritus en levenskwaliteit
De resultaten zijn in het voordeel van ixekizumab, met percentages PASI 75, 90 en 100 van respectievelijk 89%, 78% en 50%, versus 25%, 5% en 2% in de placebogroep (p < 0,001). Voor de sPGA (0,1) en de sPGA (0) bedroegen die percentages respectievelijk 81% versus 11% (p < 0,001) en 52% versus 2% (p < 0,001).
Voor de populatie die naar 3 groepen gerandomiseerd werd, was het percentage PASI 75 na 12 weken respectievelijk 84% voor ixekizumab, 63% voor etanercept en 26% voor de placebo. Voor de sPGA (0,1) was dat 76%, 53% en 5%.
In de groep met ixekizumab werd ook een sterkere verbetering van de pruritus (stijging van minstens 4 punten op de NRS-schaal [itch numeric rating scale]) en van de levenskwaliteit (score van 0 of 1 op de CDLQI-schaal bij patiënten jonger dan 16 jaar, op de DLQI-schaal bij patiënten van 17 jaar of ouder) waargenomen: de percentages waren 71% versus 20% voor de vermindering van de pruritus (p < 0,001), en 64% versus 23% voor de stijging van de levenskwaliteit (p < 0,001).
Lichte tot matige bijwerkingen, zonder onverwachte voorvallen
Het percentage bijwerkingen in week 12 bedroeg 45% in de placebogroep, 43% in de groep met etanercept en 56% in de groep met ixekizumab. Er is geen enkele ernstige bijwerking opgetreden met ixekizumab, en er werden geen onverwachte voorvallen waargenomen. De bijwerking die het vaakst werd gezien met ixekizumab was een reactie op de plaats van injectie, die in 12% van de gevallen werd waargenomen tijdens de gerandomiseerde fase en in 20% van de gevallen in de periode die zowel de gerandomiseerde als de extensiefase omvatte.